VII. JABONES, SAPONINAS Y DETERGENTES
M
UCHAS veces hemos visto maravillados cómo en una fría mañana invernal los patos nadan en el estanque sin una aparente preocupación por ser mojados por las frías aguas; cuando por fin dejan el estanque, simplemente se sacuden de las gotas superficiales y su plumaje queda tan seco como antes de su contacto con el agua. Al observar las aguas estancadas es frecuente ver insectos que con gran seguridad van y vienen corriendo sobre la superficie del agua. Ambos fenómenos tienen que ver con el hecho muy conocido de que el agua y el aceite no se mezclan.Tanto el cuerpo del insecto como el plumaje de los patos se encuentran cubiertos por una capa de grasa que los hace impermeables.
Cuando la ropa u otros objetos se manchan con grasa y tratamos de lavarlos con agua sucederá lo mismo que con el plumaje de los patos: el agua no moja a la mancha de aceite. El agua, por lo tanto, no sirve para limpiar objetos sucios con aceites o grasas; sin embargo, con la ayuda de jabón o detergente sí podemos eliminar la mancha de grasa. El efecto limpiador de jabones y detergentes se debe a que en su molécula existe una parte lipofílica por medio de la cual se unen a la grasa o aceite, mientras que la otra parte de la molécula es hidrofílica, tiene afinidad por el agua, por lo que se une con ella; así, el jabón toma la grasa y la lleva al agua formando una emulsión (Figura 16).
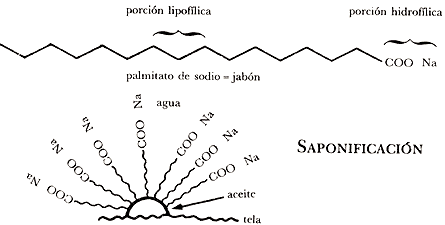
SAPONIFICACIÓN
Los jabones se preparan por medio de una de las reacciones químicas más conocidas: la llamada saponificación de aceites y grasas.
Los jabones se preparan por medio de una de las reacciones químicas más conocidas: la llamada saponificación de aceites y grasas.
Los aceites vegetales, como el aceite de coco o de olivo, y las grasas animales, como el sebo, son ésteres de glicerina con ácidos grasos. Por eso cuando son tratados con una base fuerte como sosa o potasa se saponifican, es decir producen la sal del ácido graso conocida como jabón y liberan glicerina. En el caso de que la saponificación se efectúe con sosa, se obtendrán los jabones de sodio, que son sólidos y ampliamente usados en el hogar. En caso de hacerlo con potasa, se obtendrán jabones de potasio, que tienen consistencia líquida.
La reacción química que se efectúa en la fabricación de jabón se puede representar en forma general como sigue:
| CH2—O—CO—R | CH2—OH | |||||
| | | | | |||||
| CH—O—CO—R | + | 3 NaOH |  | CH—OH | + | 3 R—CO—ONa |
| | | | | |||||
| CH2—O—CO—R | CH2—OH | |||||
| Aceite | + | sosa |  | glicerina | + | jabón |
Con frecuencia se agrega brea en el proceso de saponificación obteniéndose así jabones en los que, junto con las sales de sodio de ácidos grasos, se tendrá la sal de sodio de ácidos resínicos, lo que los hace más solubles y más apropiados para lavar ropa. Evidentemente se podrán obtener sales de ácidos grasos con otros metales, especialmente con calcio, ya que el hidróxido más abundante y barato es la cal,Ca(OH)2. Ahora bien, si la saponificación se hace con cal, el producto será el jabón de calcio, Ca(OCOR)2. El problema es que este jabón es un sólido duro e insoluble, por lo que no sirve para los fines domésticos a los que se destinan los jabones de sodio.
Los jabones de sodio tienen un amplio uso en nuestra civilización, por lo que la industria jabonera es una de las más extensamente distribuidas en el mundo entero.
FABRICACIÓN DE JABÓN
El proceso de fabricación de jabón es, a grandes rasgos, el siguiente: se coloca el aceite o grasa en un recipiente de acero inoxidable, llamado paila, que puede ser calentado mediante un serpentín perforado por el que se hace circular vapor. Cuando la grasa se ha fundido ±8Oº, o el aceite se ha calentado, se agrega lentamente y con agitación una solución acuosa de sosa. La agitación se continúa hasta obtener la saponificación total. Se agrega una solución de sal común (NaCl) para que el jabón se separe y quede flotando sobre la solución acuosa.
El proceso de fabricación de jabón es, a grandes rasgos, el siguiente: se coloca el aceite o grasa en un recipiente de acero inoxidable, llamado paila, que puede ser calentado mediante un serpentín perforado por el que se hace circular vapor. Cuando la grasa se ha fundido ±8Oº, o el aceite se ha calentado, se agrega lentamente y con agitación una solución acuosa de sosa. La agitación se continúa hasta obtener la saponificación total. Se agrega una solución de sal común (NaCl) para que el jabón se separe y quede flotando sobre la solución acuosa.
Se recoge el jabón y se le agregan colorantes, perfumes, medicinas u otros ingredientes, dependiendo del uso que se le quiera dar. El jabón se enfría y se corta en porciones, las que enseguida se secan y prensan, dejando un material con un contenido de agua superior al 25%.
ACCIÓN DE LAS IMPUREZAS DEL AGUA SOBRE EL JABÓN
Cuando el agua que se usa para lavar ropa o para el baño contiene sales de calcio u otros metales, como magnesio o fierro, se le llama agua dura.
Cuando el agua que se usa para lavar ropa o para el baño contiene sales de calcio u otros metales, como magnesio o fierro, se le llama agua dura.
Este tipo de agua ni cuece bien las verduras ni disuelve el jabón. Esto último sucede así, porque el jabón reacciona con las sales disueltas en el agua y, como consecuencia, produce jabones insolubles, de acuerdo con la siguiente reacción:
Por tanto, cuando se utilizan aguas duras, la cantidad de jabón que se necesita usar es mucho mayor, ya que gran cantidad de éste se gasta en la formación de sales insolubles. Como consecuencia de ello, el jabón no produce espuma hasta que todas las sales de calcio o magnesio se han gastado produciendo una sustancia insoluble, la cual, además de su mal aspecto, une su acción deteriorante de las telas, puesto que ese material duro queda depositado entre los intersticios de los tejidos.
De la misma forma, cuando el agua dura se usa en calderas, la sal de estos metales se adhiere a los tubos dificultando el intercambio de calor y, por lo tanto, disminuyendo su eficiencia.
DETERGENTES
Los primeros detergentes sintéticos fueron descubiertos en Alemania en 1936, en lugares donde el agua es muy dura y por lo tanto el jabón formaba natas y no daba espuma. Los primeros detergentes fueron sulfatos de alcoholes y después alquilbencenos sulfonados, más tarde sustituidos por una larga cadena alifática, generalmente muy ramificada.
Los primeros detergentes sintéticos fueron descubiertos en Alemania en 1936, en lugares donde el agua es muy dura y por lo tanto el jabón formaba natas y no daba espuma. Los primeros detergentes fueron sulfatos de alcoholes y después alquilbencenos sulfonados, más tarde sustituidos por una larga cadena alifática, generalmente muy ramificada.
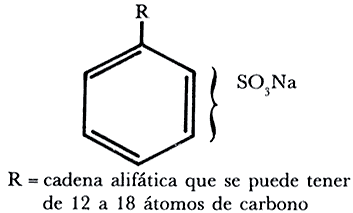
Los resultados fueron positivos, pues al usarse en agua muy dura siguieron dando abundante espuma por no formar sales insolubles con calcio y otros constituyentes de las aguas duras.
Dado que los detergentes han resultado ser tan útiles por emulsionar grasas con mayor eficiencia que los jabones, su uso se ha popularizado, pero, contradictoriamente, han creado un gran problema de contaminación, ya que muchos de ellos no son degradables. Basta con ver los ríos rápidos que llevan las aguas municipales para darse cuenta de cómo se elevan en ellos verdaderas montañas de espuma. Para evitar esto, se han hecho esfuerzos por sustituir la cadena lateral (R) ramificada por una cadena lineal, la que sí sería biodegradable. Los detergentes son muy variados, y los hay para muy diversos usos; simplemente, para ser efectivos en las condiciones de temperatura que se acostumbran en el lavado industrial de los distintos pueblos de la Tierra, tiene que variar su formulación.
El lavado industrial en Europa se acostumbra hacer a alta temperatura, entre 90 y 95° Por su parte, en los Estados Unidos se hace entre 50 y 60°, mientras que en México se realiza a temperatura ambiente.
Las diferentes condiciones de temperatura en las que se realiza el lavado trae problemas a los fabricantes de detergentes. Éstos deben estar seguros de que el detergente se disuelve en agua a la temperatura adecuada. Los detergentes más comunes en los Estados Unidos no son fácilmente solubles en frío. Los agentes blanqueadores como el perborato, que funciona bien en caliente, cuando se utiliza en frío tiene que ser reforzado con activadores, pues en agua tibia los blanqueadores pierden eficiencia.
ENZIMAS
Estos materiales adquirieron gran popularidad en Estados Unidos y Europa en la década de los sesenta debido a su facultad de eliminar manchas proteicas o carbohidratos, aun en el remojo. Los detergentes con esta formulación son capaces de eliminar manchas de sangre, huevo, frutas, etcétera.
Estos materiales adquirieron gran popularidad en Estados Unidos y Europa en la década de los sesenta debido a su facultad de eliminar manchas proteicas o carbohidratos, aun en el remojo. Los detergentes con esta formulación son capaces de eliminar manchas de sangre, huevo, frutas, etcétera.
Con todo, estos detergentes han producido problemas de salud en los obreros que trabajan en su elaboración. Por suerte, hasta ahora no los han provocado en las amas de casa.
El problema con los obreros se debió principalmente a que los detergentes producen polvo que, al ser aspirado, pasa a los pulmones. Esto se ha resuelto fabricando detergentes con gránulos mayores, para que no produzcan polvo.
Los fabricantes de detergentes de Europa y Japón están poniendo enzimas en la mayor parte de sus productos.
Entre las sustancias que se agregan a los detergentes para mejorar sus características se encuentran ciertas sustancias que protegen a las telas contra la fijación del polvo del suelo o el atmosférico. Estas sustancias, que mantienen a las telas limpias por más tiempo al evitar la reimplantación del polvo, son sin duda de gran utilidad, pues evitan trabajo y deterioro de la tela.
Una sustancia con esas propiedades es la carboxi-metilcelulosa, que es eficiente en algodón y otras telas celulósicas, pero falla con telas sintéticas.
Los ácidos carboxílicos secuestran la dureza del agua reaccionando con las sales metálicas presentes en esas aguas.
El tripolifosfato de sodio es un excelente secuestrante y por muchos años se ha usado con óptimos resultados. Por desgracia en los Estados Unidos se empezaron a observar efectos de eutrofisación de las aguas, por lo que su uso está siendo severamente restringido.
Lo mismo está sucediendo en Europa, donde también se han descubierto daños por eutrofisación, fenómeno que consiste en el aumento de nutrientes a un ritmo excesivo, por lo que al descomponerse la materia prima orgánica que ingresa (detergentes), disminuye el oxígeno disuelto, alterando la vida en las aguas.
La industria de jabones y detergentes que contribuye a mantener a nuestro mundo libre de inmundicias, es muy grande. En 1984 fue de 24 millones de toneladas y tan sólo en América Latina se produjeron 2.7 millones de toneladas.
SAPONINAS
Antes de que el hombre creara la gran industria del jabón se usaban jabones naturales llamados saponinas (nombre derivado del latín sapo, jabón) y conocidos por los mexicanos como amole. Muchas raíces y follaje de plantas tienen la propiedad de hacer espuma con el agua, por lo que se han utilizado desde la Antigüedad para lavar ropa. Los pueblos prehispánicos del centro de México llamaban amole a estas plantas y eran sus jabones. Aun en la actualidad en muchas comunidades rurales se emplea el amole tanto para lavar ropa fina, como para evitar que se deteriore, ya que es un detergente neutro perfectamente degradable.
Antes de que el hombre creara la gran industria del jabón se usaban jabones naturales llamados saponinas (nombre derivado del latín sapo, jabón) y conocidos por los mexicanos como amole. Muchas raíces y follaje de plantas tienen la propiedad de hacer espuma con el agua, por lo que se han utilizado desde la Antigüedad para lavar ropa. Los pueblos prehispánicos del centro de México llamaban amole a estas plantas y eran sus jabones. Aun en la actualidad en muchas comunidades rurales se emplea el amole tanto para lavar ropa fina, como para evitar que se deteriore, ya que es un detergente neutro perfectamente degradable.
Las saponinas se han usado también como veneno de peces, macerando en agua un poco del órgano vegetal que lo contiene, con la ventaja de que los peces muertos por este procedimiento no son tóxicos.
Las saponinas producen hemolisis a grandes diluciones y están constituidas por grandes moléculas orgánicas, como esteroides o triterpenos, unidas a una o varias azúcares, por lo que contienen los elementos necesarios para emulsionar la grasa: una parte lipofílica, que es el esteroide o triterpeno, por medio del cual se unirá a la grasa, y una parte hidrofílica, que es el azúcar, por medio de la cual se unirá al agua.
Entre las saponinas de naturaleza esteroidal son muy importantes los glicósidos cardiacos, obtenidos de la semilla de la dedalera o Digitalis purpurea. El extracto obtenido de estas semillas, que contienen una mezcla de saponinas, es muy útil en el tratamiento de enfermedades del corazón. Sin embargo, un exceso de estas sustancias es peligroso y puede causar incluso la muerte. Debido a esto, las infusiones de dedalera se utilizaron en la Edad Media en los juicios de Dios (ver capítulo v).
Los glucósidos cardiacos se encuentran no sólo en la dedalera, sino que hay otras plantas que también las contienen, tales como las distintas especies de la familia Asclepidacea.
Esta familia de plantas es rica en ellos, y su principal característica es la producción de un jugo lechoso cuando se le cortan hojas o tallos. Ha adquirido notoriedad por ser las plantas que alimentan a la mariposa monarca en su estado larvario. De esta planta las mariposas toman los glicósidos cardiacos que la volverán tóxica y por consiguiente desaniman a las aves a que las consuman como alimento. Algunos de estos glicósidos son los que se ilustran enseguida:
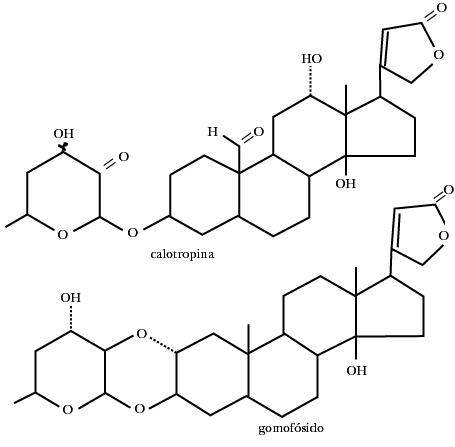
Entre las asclepidáceas que han interesado a los investigadores se encuentra la Calotropis procera que crece en Asia y en África. Es una planta venenosa que ha sido utilizada para la medicina popular y como veneno de flechas, es decir, los nativos usan el látex venenoso de la planta para impregnar los dardos. Así, en la práctica de la cacería, los animales, aunque sean heridos muy levemente, mueren. La carne no representa ningún problema, ya que la sustancia se descompone durante el cocinado, y si algo llega al estómago, el ácido clorhídrico del jugo gástrico se encargará de hidrolisarlo quitándole su toxicidad.
Las sustancias que contiene esta planta son una serie de lactonas, entre las que se han podido caracterizar las llamadas calactina, calotropina y las sustancias que contienen nitrógeno y azufre en su molécula, como la voluscharina y la uscharina.
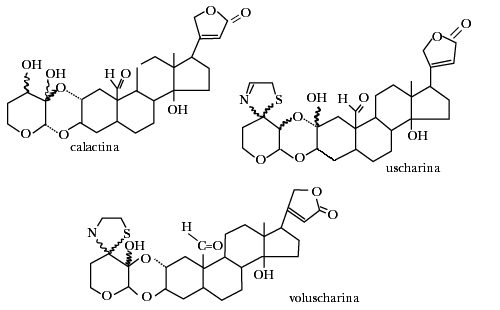
La hidrólisis de los glicósidos cardiotónicos de la dedalera (Digitalis purpurea) elimina la parte hidrofílica constituida por azúcares y deja en libertad la parte lipofílica que en este caso son los esteroides digitoxigenin, digoxigenina y gitoxigenina, que además de que ya no tienen propiedades detergentes, han perdido su actividad biológica
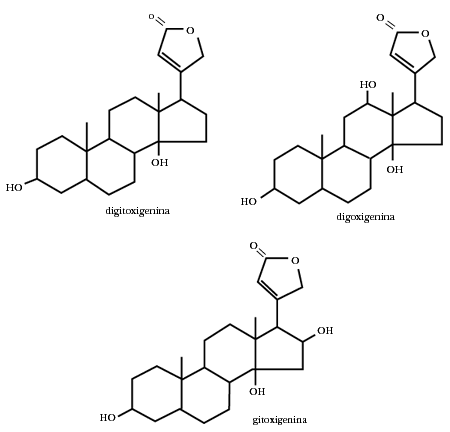
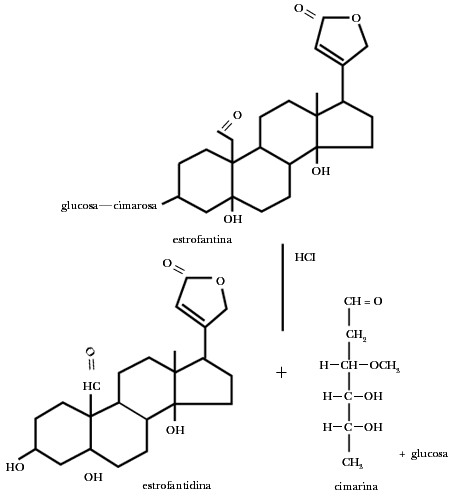
Los glicósidos cardiacos son saponinas producidas también por otras plantas venenosas, entre ellas las del género Strophantus. Por ejemplo, tenemos la strofantina, que contiene glucosa, la cual, unida directamente al esteroide, contiene una azúcar muy rara llamada cimarosa. La estrofantidina es un veneno muy activo, capaz de matar en dosis tan bajas como 0.07 mg a un ratón de 20 gramos.
No hay comentarios:
Publicar un comentario